Perkembangan Model Atm diawali dalam kasus pendapat seorang Filsuf Yunani yang bernama Democritus bahwa jika ada sesuatu benda dibelah terus-menerus itu akan didapat bagian yang tidak dapat dibelah lagi. Bagian tersebut dinamakan Atom oleh Democritus. Ialah istilah Atom yang berasal dari bahasa yunani kuno dan kemudian disempurnakan menjadi Atom adalah suatu bagian yang kecil dari suatu unsur dan tidak dapat dibagi-bagi lagi, namun masih memiliki sifat-sifat kimia dan sifat fisika benda asalnya.
John Dalton
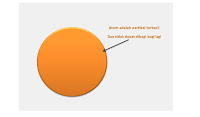
John Dalton adalah seorang guru di Inggris, iya memikirkan tentang Atom. Bayangan Dalton dan Democritus yaitu bahwa Atom itu berbentuk bola pejal (gambar 1.0). Dalton mengemukakan postulatnya tentang Atom, yaitu :
- Setiap unsur terdiri dari partikel kecil yang dinamakan dengan Atom,
- Atom dari unsur yang sama memiliki sifat yang sama, begitu pula Atom yang berbeda unsurnya,
- Atom dari suatu unsur tidak dapat diubah menjadi unsur lain dengan reaksi kimia, maupun dihancurkan atau dimusnahkan,
- Atom-atom dapat bergabung membentuk gabungan yang disebut molekul,
- Dalam senyawa, perbandingan massa masing-masing unsurnya tetap.
 |
| (gambar 1.0) |
Dalam teori Dalton mulai membangkitkan minat para peneliti mengenai Model Atom. Yang tetapi teori Dalton begitu kurang untuk suatu penjelasan bahwa suatu larutan bisa menghasilkan arus listrik atau bagai mana mugkin bola pejat itu dapat menghantarkan arus listrik, padahal arus listrik tersebut adalah elektron yang bergerak, jadi para peneliti bertanya-tanya bahwa ada partikel lain yang dapat menghantarkan arus listrik.
J.J Thomson (gambar 1.1)
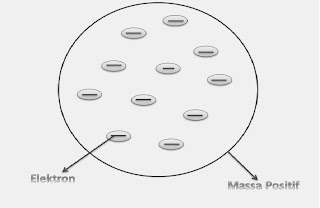
J.J Thomson adalah orang memperbaiki kelemahan teori Dalton. Ia melakukan ekperimen didalam tabung sinar kotoda, Hasilnya menyatakan ada pertikel bermuatan negatif dalam Atom yang disebut elektron (Gambar 1.2). Kelebihan model Atomnya membuktikan adanya partikel lain yang bermuatan negatif dalam Atom, yang artiya Atom bukan merupakan bagian terkecil dari suatu unsur. Sedangkan kelemahan model Atom Thomson, tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tesebut.
 |
| (gambar 1.1) |
.jpg) |
| Sinar dihasilkan dari Kotoda (gambar 1.2) |
.jpg) |
| Didekatkan dengan magnet sinar dibelokan (gambar 1.2) |
Model Atom Rutherford (gambar 1.3)
Rutherford melakukan penelitian tentang hamburan sinar alfa (λ) pada lempengan emas. Sebelumnya ia menentukan adanya partikel alfa, yaitu partikel yang bermuatan positif dan bergerak lurus,serta berdaya tembus besar sehingga dapat menembus lembaran tipis emas. Berdasarkan hasil pengamatan/percobaan tersebut iya mengusulkan model atom yang dikenal dengan model atom Retherford yang menyatakan bahwa atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dan Elektron yang mengelilinginya dengan bermuatan negatif. Retherford juga menduga bahwa dalam nti atom terdapat partiel netral yang berfungsi mengikat partikel tersebut agar tidak saling tolak menolak. Dalam kelemahannya iya tidak menjelaskan mengapa elektron tidak jauh ke dalam inti atom.
 |
| (gambar 1.3) |
Model Atom Niels Bohr (gambar 1.4)
Niels Bohr meneruskan dan memperbaiki teori model atom Rutherford pada. Pendekatan yang dilakukannya adalah sifat dualisme yang dapat bersifat sebagai partikel dan dapat sebagai gelombang, membuktikan bahwa Bohr dengan melihat spektrum dari atom hidrogen yang dipanaskan. Spektrum menghasilkan sangat spesifikasi hanya cahaya dari frekuensi tertentu. Yang dihasilkan Spektrum tersebut merupakan suatu gambaran bahwa elektron mengelilingi inti, beberapa Spektrum menhasilkan mengidentifikasi bahwa elektron mengelilingi inti dalam berbagai tingkat energi. Hasil dari yang dikembangkan oleh Bohr bahwa Atom tersusun atas inti bermuatan positif dan dikelilingi oleh elektron yang bermuatan negatif. Elektron tersebut mengelilingi inti atom pada orbit tertentu, yang dapat berpindah lebih tinggi dengan menyerap energi, sebaliknya elektron tesebut dapat berpindah dari orbit yang lebih tinggi ke rendah dengan melepaskan energi, dan stasionernya tetap dengan tingkat energi tertentu. Pada keadaan normal yang tanpa pengaruh luar, elektron menepati tingkat energi terendah yang disebut tingkat dasar (Groud State).
Niels Bohr menganjurkan untuk teori atom ini hanya dapt ,emjelaskan hubunga memuaskan untuk atom yang lebih besar.
 |
| (gambar 1.4) |
Klemahan model atom Bohr itu tidak menjelaskan efek Zeeman dan efek Strack, serta tidak dapat menjelaskan kejadian-kejadian dalam ikatan terhadap atom-atom itu, dan spektrum atom yang berelektron lebih banyak.
Model Atom Modern
Selanjutnya model atom dikembangkan oleh Erwin Schroddinger yang sebelumnya dari seorang ahli dari Jerman Werner Heisenberd, mengembangkan teori mekanika kuantum yang dikenal dengan prinsif ketidak pastian atau yang dimaksud " Tidak mungkin dapat ditentukan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan. Yang dapat ditentukan itu adalah keboleh jadian elektron pada jarak tertentu dari inti atom.
Bentuk dan tingkat energi orbital
dirumuskan oleh Erwin Schrodinger,
iya memecahkan suatu persamaan (gambar 1.5), untuk mendapatkan fungsi gelombang untuk
menggambarkan batas kemungkinan,
serta ditemukannya elektron dalam tiga dimensi.
 |
| Persamaan Schrodinger |
Yang disebut model atom modern atau model atom mekanika kantum adalah suatu model atom dengan orbital lintasan elektron. Model ini berlaku sampai sekarang ini, digambarkan seperti gambar dibawah ini :
 |
| Model Atom Mutakhir atau Model Atom Mekanika Gelombang |
Awan elektron yang ada pada sekitar inti atom menunjukan tempat kebolehan jadian elektron. Orbital mengambarkan tingkatan energi elektron. Pada beberapa sub kulit tersebut, terdiri dari beberapa sub kulit dan sub kulit terdiri dari beberapa orbital. Orbital-orbital dengan tingkatan energi yang tinggi dan sama atau hampir sama serta membentuk sub kulit. Walau pun posisi kulitnya sama, tetapi posisi orbitalnya belum tentu sama.
Didalam Model Atom Mekanika Gelombang, mempunyai ciri-ciri khas, bahwa gerakan
elektron memiliki sifat gelombang, sehingga lintasan orbitnya tidak stasioner seperti model Bohr, tetapi
mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital atau maksudnya “bentuk
tiga dimensi darikebolehjadian paling besar ditemukannya elektron dengan keadaan
tertentu dalam suatu atom”. Dalam
bentuk dan ukuran orbital bergantung pada harga
dari ketiga bilangan kuantumnya atau Orbital yang ditempati Elektron dinyatakan dalam bilangan kuantum tersebut. Dan posisi
elektron sejauh 0,529 Amstrong dari inti H menurut Bohr bukannya sesuatu yang
pasti, tetapi boleh jadi merupakan peluang terbesar ditemukannya electron. Kelemahan Model Atom Modern Adalah persamaan gelombangn Schrodinger hanya dapat diterapkan secara diterapkan secara eksa untuk partikel dalam kotak dan Atom Elektron Tunggal.
(Percobaan Chadwick)







No response to “Perkembangan Model Atom”
Posting Komentar
Tulias bila ada pertanyaan, kritik dan saran dibawah ini !